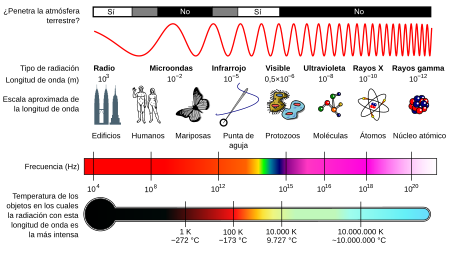
Naturaleza electromagnética de la luz.
Se realizaron varios estudios para comprender la naturaleza de la luz solar.
1. En primer lugar el científico W. Herschel descubrió que si descomponía la luz solar, más allá del rojo que perciben nuestros ojos existe una luz invisible al ojo humano pero notable por su producción de calor, esta es la luz infrarroja (IR).
2. Al año siguiente J. Ritter, descubrió otra radiación invisible , que no generaba calor pero sí cloruro de plata (AgCl). Esta es la luz ultravioleta (UV).
3. Años más tarde Maxwell y Hertz descubrieron que estas ondas luminosas eran electromagnéticas, lo que permitió más tarde el descubrimiento de las ondas microondas, los rayos X y los rayos γ.
Estos fueron los autores de los anteriores descubrimientos:

Espectroscopia atómica.
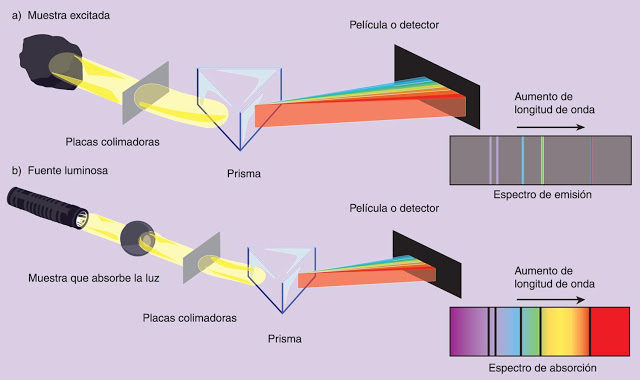
En este tipo de espectroscopia los átomos aislados pueden emitir y absorber radiación electromagnética. Hay dos tipos:
1. El espectro de emisión atómica se obtiene mediante la excitación de átomos con una fuente de energía externa, la que hace que estos produzcan luz, esta se descompone y analiza formando dicho espectro.
2. El espectro de absorción atómica que se obtiene iluminando una muestra y analizando el espectro de luz que ha atravesado los átomos.
- Estos espectros son discontinuos al no contener todas las frecuencias, a cada una de estas frecuencias les corresponde una fina raya llamada línea, estas son como las huellas dactilares que identificarán al elemento químico tratado en cuestión.
Otros tipos de espectroscopias:
Espectroscopia IR.
La espectometría infrarroja es un tipo de espectometría de absorción que utiliza la región infrarroja del espectro electromagnético. Esta tiene como función determinar la composición de una muestra o identificar un compuesto. Está basada en las frecuencias de vibración concretas de los elementos químicos de ciertas sustancias, las cuales corresponden a los niveles de energía de una molécula. Estas moléculas son capaces de vibrar de distinto modo:
- Una de las cosas por las que se diferencian con los espectros atómicos es que no se obtienen líneas , sino zonas anchas de absorción llamadas bandas del espectro.

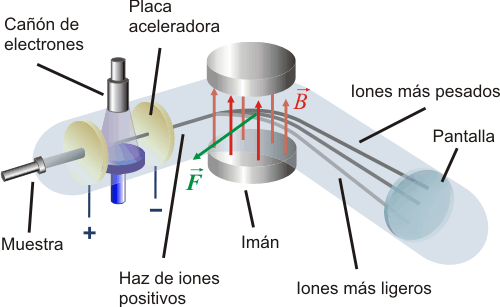
Espectroscopia de masas.
El espectro obtenido en la espectometría de masas no es, al igual que en los anteriores, una serie de radiaciones electromagnéticas, sino de fragmentos de materia. Se aplica principalmente en la determinación de masas atómicas o moleculares debido a su exactitud y fiabilidad.
Y con esto se acaba el tema de hoy, espero que os haya parecido interesante y como siempre si queréis saber más aquí os dejo de donde he sacado la información:
~Libro de física y química de 1º de Bachillerato Anaya.
¡HASTA PRONTO 100TÍFICOS!